第七章配位滴定法
概念,条件
1.配位滴定定法是以分析物与滴定剂之间形成稳定配合物的配位反应为基础的滴定方法,也称络合滴定法
2.反应能定量进行完全
配位反应按一定的反应式定量进行
生成的配位数必须稳定
反应必须迅速
有适当的方法确定滴定终点
配位滴定的基本原理
EDTA与金属离子形成1 :1配合物
化学计量点pM的计算
pM'=
影响配位滴定突跃大小的因素
一定, 越大滴定曲线的起点越低,
突跃范围越大,反之突跃范围越小
1.
2.
EDTA滴定金属离子的条件
lg
酸度范围与条件选择
最高酸度:
最低酸度:
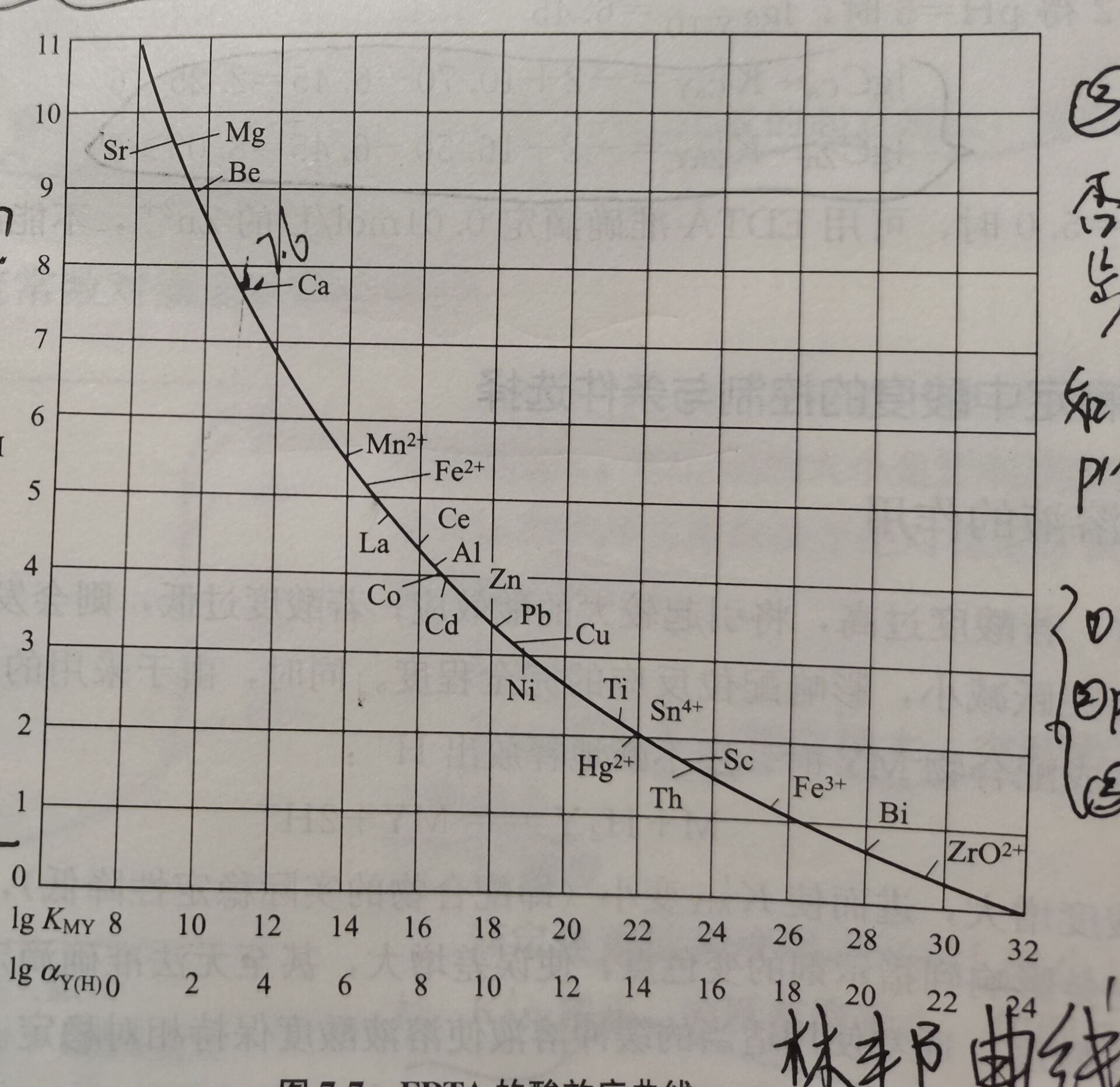 :EDTA酸效应曲线图
:EDTA酸效应曲线图1.准确滴定某金属离子的PH X?
2.判断在某PH时,哪些离子可以被准确滴定
3.控制酸度是否能够实现分步滴定
也称林邦曲线
EDTA的性质及其配合物
乙二胺四乙酸二钠
水溶性好
时100ml水溶解10.8g,约0.3mol/L
PH=4.42
EDTA存在形式
, ;
金属EDTA配合物分析特性
广泛性
简单性
稳定性
水溶性
颜色倾向性
金属指示剂
作用原理及条件
M+In MIn
色A 色B
1.指示剂与金属离子形成的配合物(MIn)与指示剂本身(In) 的颜色应有显著差别。
2.显色反应灵敏、迅速,有良好的变色可逆性。
3.指示剂与金属离子配合物的稳定性要适当。既要有足够的稳定性(KMIn≥104), 但又要比该金属离子与EDTA配合物的稳定性小(KMy/KMIn≥102)。这样才能在接近化学计量点,溶液中金属离子很少的情况下,指示剂仍能与之显色;当滴定剂稍过量时立即发生反应,转变为游离指示剂的颜色,指示滴定终点的到达。
4.指示剂与金属离子形成的配合物应易溶于水。
5.指示剂与金属离子的显色应具有一定的选择性。
6.金属离子指示剂应比较稳定,便于贮存和使用。
配合物在溶液中的理解平衡
M+Y MY,
或 越大,配合物越稳定,
反之配合物越不稳定
影响因素
酸效应:由于溶液酸度引起配位体Y参加主反应能力降低的现象
衡量酸效应大小:
酸度越高,Y浓度越低, 越大,酸效应越显著
越不利于MY的形成。 =1,无影响
共存离子效应及共存离子效应系数
=1+[N]
加入隐蔽剂解决
条件稳定常数
提高配位滴定的选择性
EDTA
优点:普遍性
缺点:选择性差
消除干扰离子影响条件:减小 消除干扰
不干扰:
干扰:
提高选择性
1.控制酸度
2.掩蔽干扰离子