电位法及双指示电极电流滴定法
电位法的基本原理
电化学电池
原电池:化——电
电解池:电——化
正极
电位高——正极
发生氧化反应:阳极
负极
电位低——负极
发生还原反应——阴极
书写
||:表示盐桥:[消除微小电位差],[分开正负电解质溶液],[保持电荷平衡][稳定电极电位]
|:表示不同物质的界面。若在同一电极上,物质相同,则用‘’,‘’隔开
氧化左,阳 还原右,阴
原电池表示
电极
参比电极
要求
可逆性好
重现性好
稳定性好
分类
饱和氯化汞电极
电极符号:
电极反应:
电极电位:
银--氯化银电极
电极电位:
电极反应:
电极符号:Ag(s)|AgCl(s)|KCl(c1)
定义:在一定条件下,电极电位恒定不随其待测液的变化而变化,其大小与待测液无关
指示电极
定义:在一定条件下,电极电位随其待测离子浓度的变化而变化的一类电极
要求
电极电位与待测组分浓度间符合楞斯特方程
对待测组分响应快,重现性好
简单耐用
分类
金属--金属离子电极
金属--金属难溶氧化物电极
汞--EDTA电极
金属--金属难溶盐电极
惰性金属电极
复合电极
是一种将指示电极和参比电极在制作时组合在一起的电极形式
液接电位
定义:两个浓度或组分不同的电解质溶液相接触的界面所存在的微小电位差
产生原因:正负离子的扩散速度不同
消除:盐桥
电位滴定法
原理及装置
装置
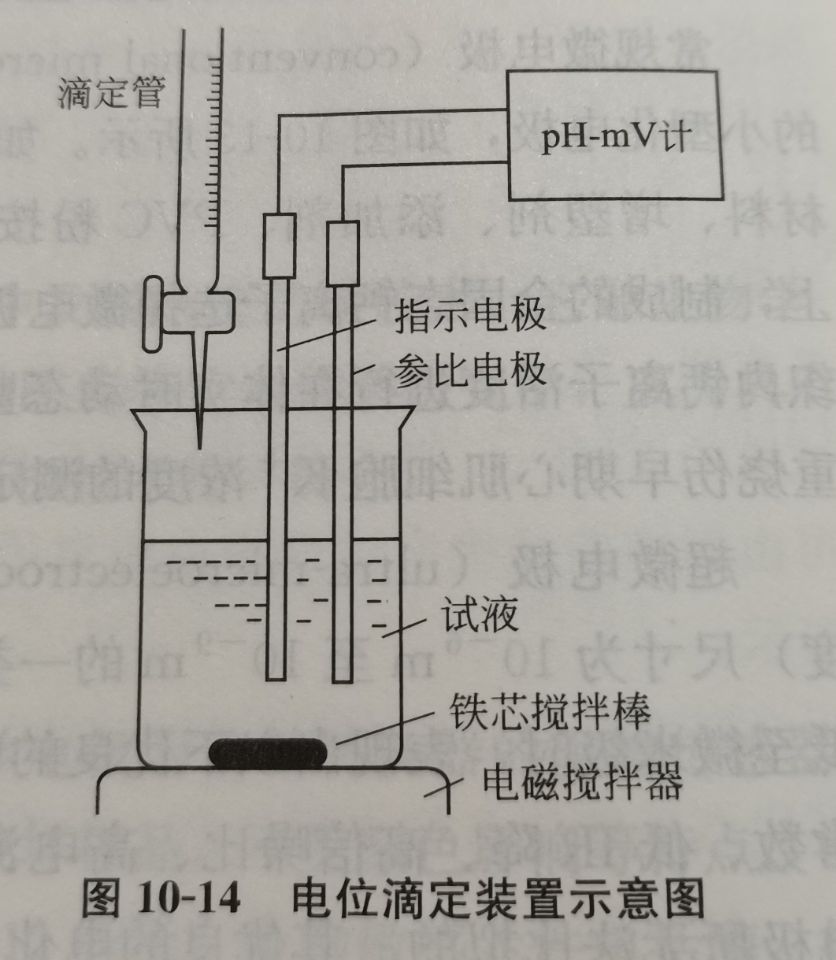
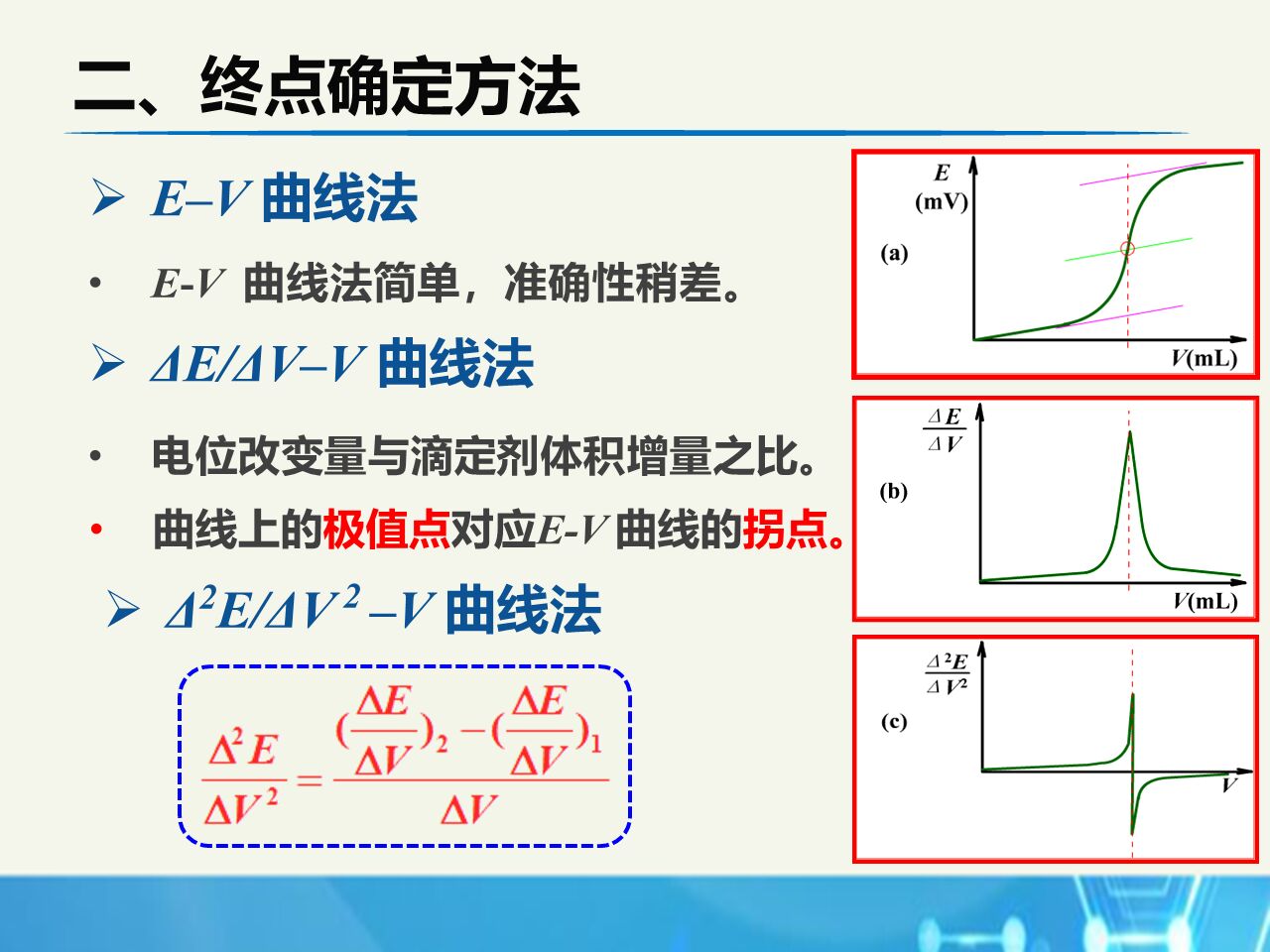
终点确定方法
应用实例
酸碱滴定
沉淀滴定
配位滴定
氧化还原滴定
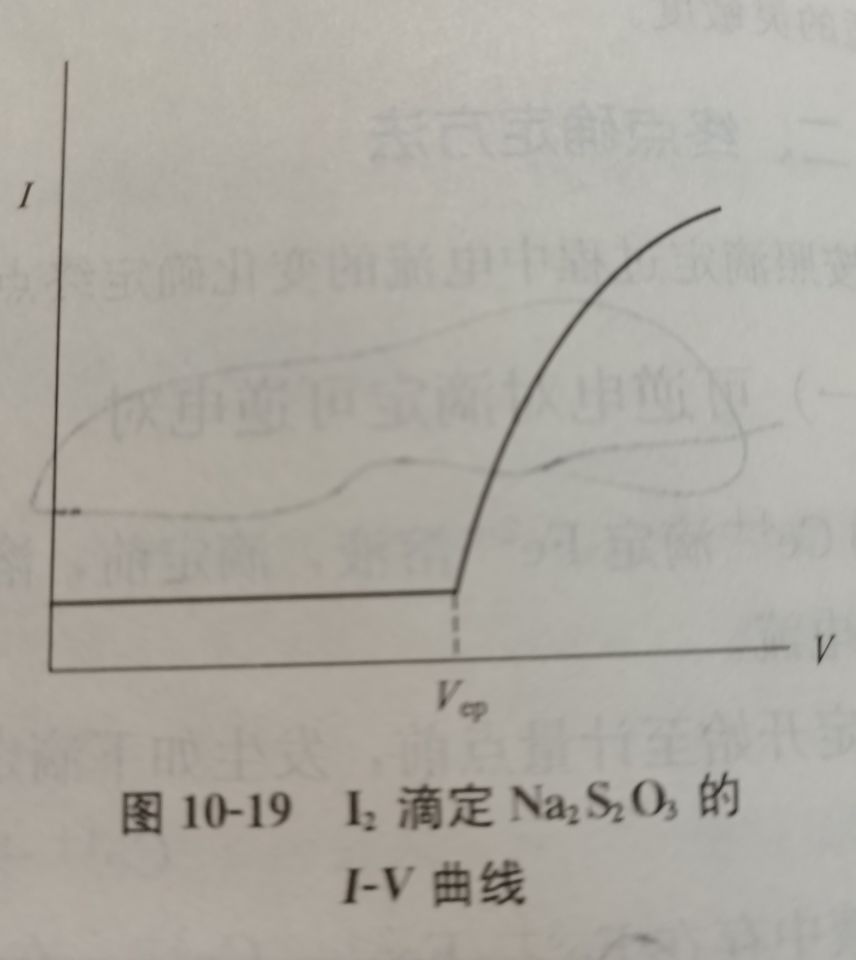
双指示电极电流滴定法
(永停滴定法)原理及装置
根据滴定过程中电流变化确定终点,属于电流滴定法
重点特点
直观准确
所用仪器简单
易于实现自动滴定
终点确定方法
可逆对可逆
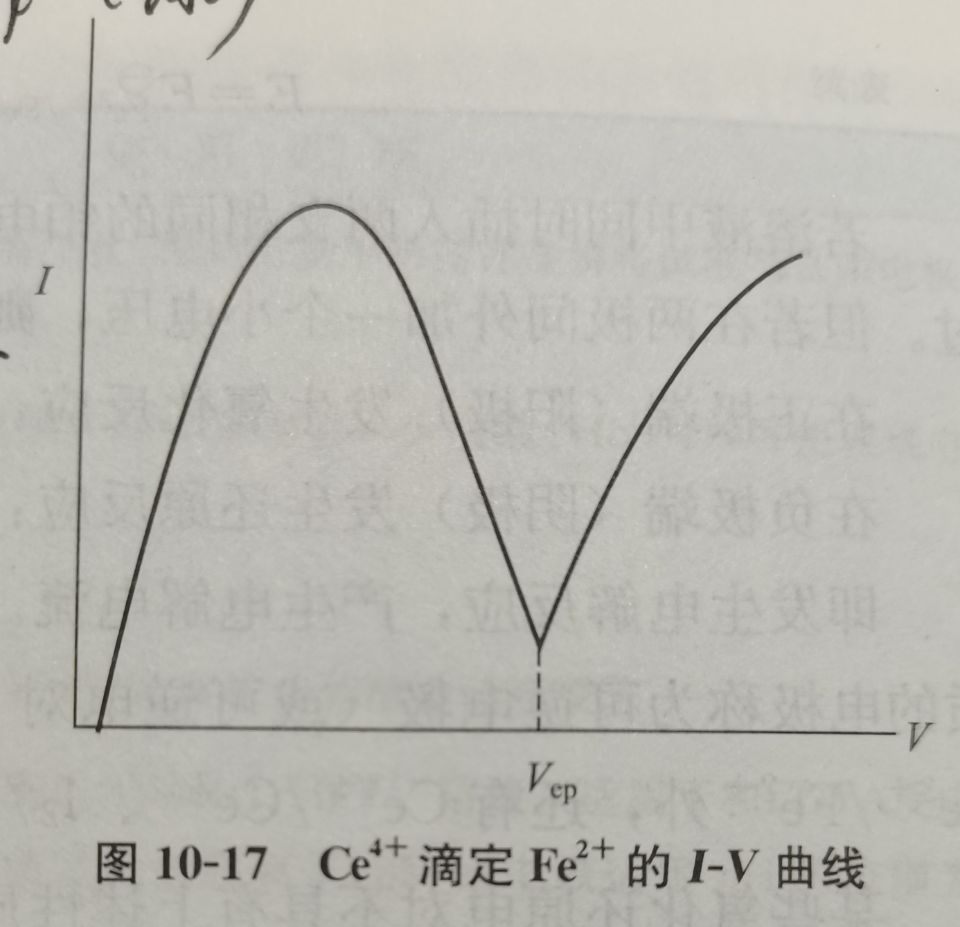
不可逆对可逆
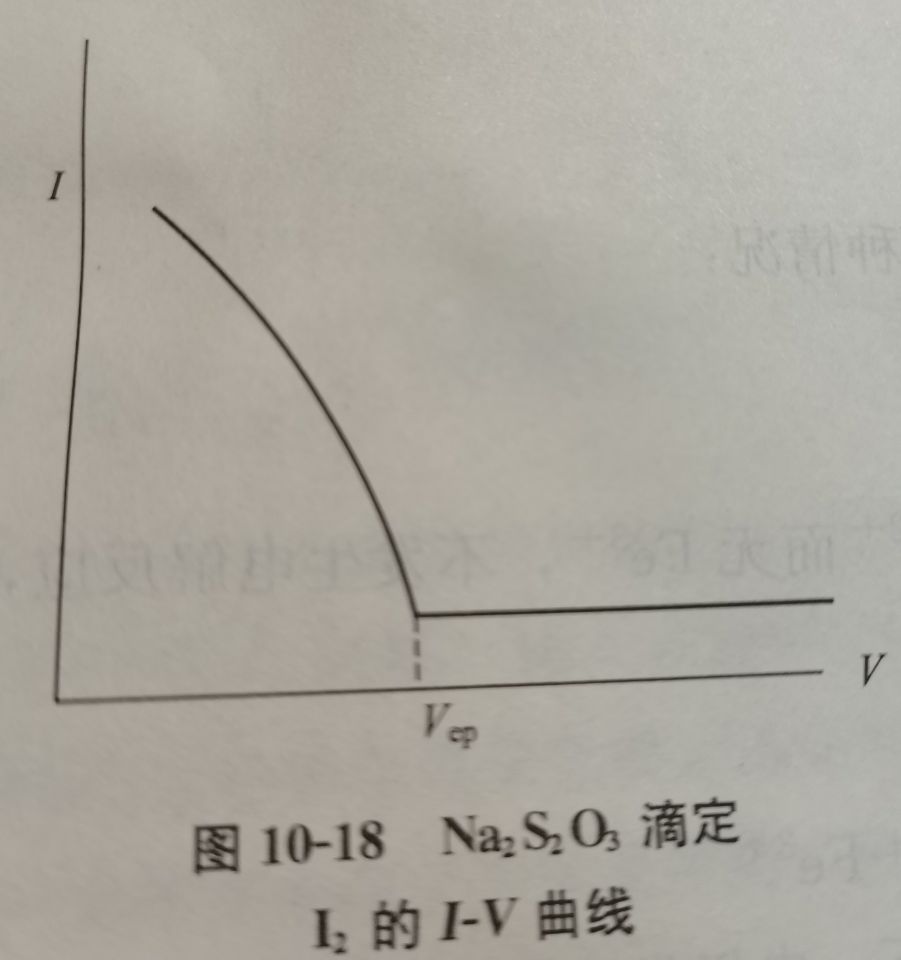
可逆对不可逆
应用实例
重氮化滴定法的终点确定
Karl—Fischer法测微量水分的终点确定
直接电位法
氢离子活度的测定
PH玻璃电极
原理:

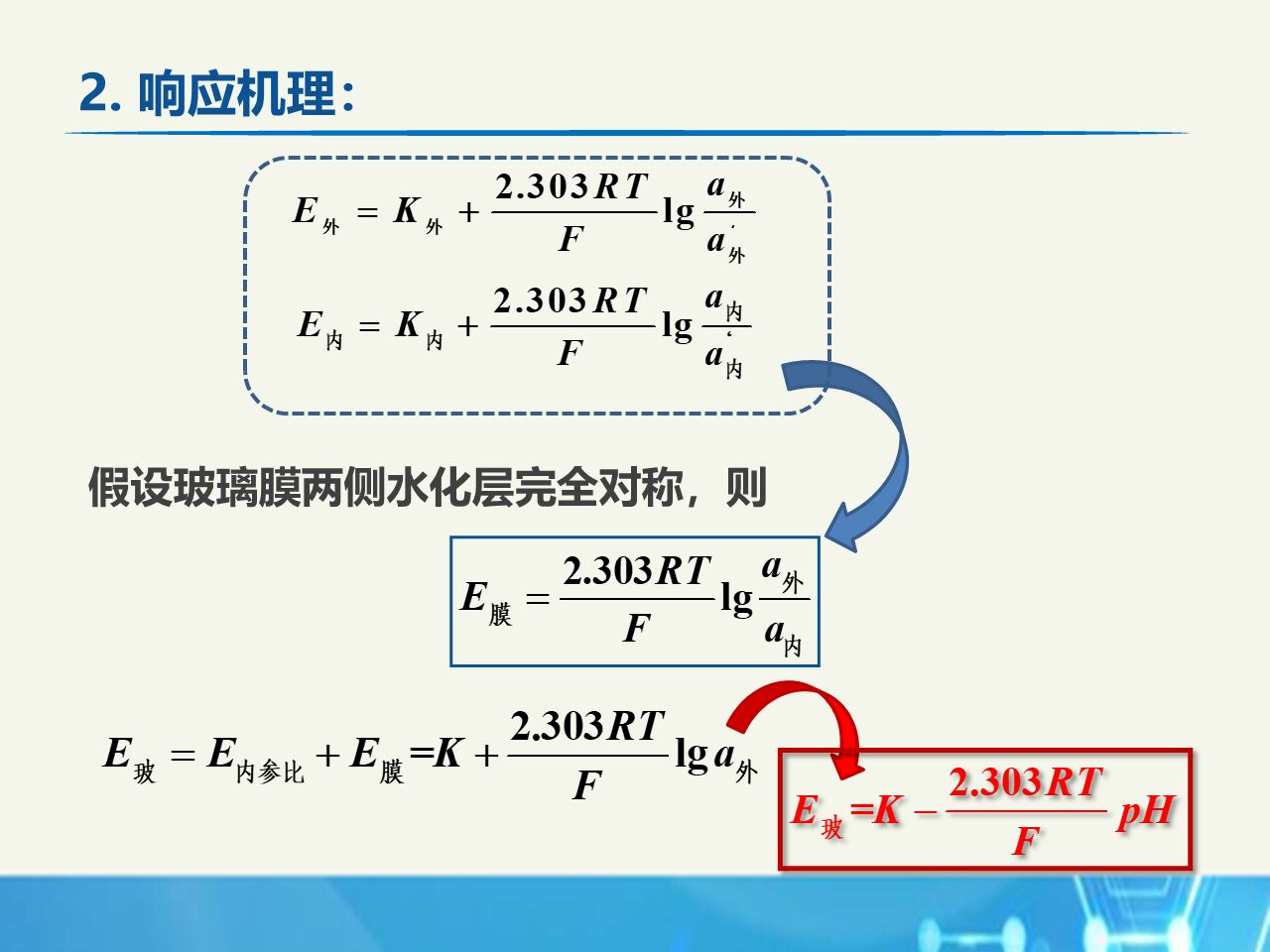
性能:
转化系数
不对称电位 膜电位有几毫伏的电位存在
碱差和酸差
电极内阻
测量原理和方法
理论依据
测量方法
步骤
开机预热30分钟
插入温度补偿计
测缓冲溶液
测pH
注意事项
保持温度恒定
使用与待测溶液pH接近的标准缓冲液
使用前活化
测定时搅拌
概论
分类
电位法:直接电位法 电位滴定法
伏安法:极谱法 溶出伏安法电流滴定法
电导法:直接导电法 电导滴定法
电解法:电重量法 库仑法 库伦滴定法
特点
精确度高,重复性好,稳定性好
不受溶液颜色,混浊度的干扰
灵敏度: